La Commissione Europea ha concesso l’autorizzazione all’immissione in commercio in Unione Europea (UE) di teplizumab per ritardare l’insorgenza dello stadio 3 del diabete di tipo 1 (DT1 o T1D da Type 1 Diabetes) in pazienti adulti e pediatrici di età superiore o uguale a 8 anni con diabete di tipo 1 in stadio 2, una fase preclinica della malattia. La decisione segue il parere positivo espresso il 14 novembre 2025 dal Committee for Medicinal Products for Human Use (CHMP) dell’Agenzia Europea per i Medicinali (EMA). Oltre che negli USA (dal 2022), teplizumab è oggi già approvato nel Regno Unito, in Cina, Canada, Israele, Arabia Saudita, Emirati Arabi Uniti e Kuwait per la stessa indicazione. Sono in corso altre revisioni normative.
Un cambiamento di paradigma nella lotta al diabete di tipo 1
Si tratta di un risultato storico per la comunità diabetologica e i pazienti europei: teplizumab è il primo trattamento autorizzato in Europa che può intervenire sulla progressione naturale del diabete di tipo 1, agendo nella fase preclinica, antecedente alla comparsa dei sintomi clinici (fase 2) e non solo sulla gestione dell’iperglicemia una volta che la malattia si è manifestata.
Questo approccio è stato definito un cambiamento di paradigma nel trattamento del diabete autoimmune perché sposta l’attenzione dalla semplice gestione della malattia alla sua prevenzione ritardata, offrendo anni di tempo prima dell’insorgenza della forma clinica manifesta che richiede la terapia con insulina.
Dopo l’approvazione del teplizumab, l’insulina non è più l’unica terapia del diabete tipo 1. Si potrà, infatti, agire prima che la malattia entri nella sua fase clinica conclamata, così da rallentarne l’esordio e possibilmente bloccarlo.
La ricerca continua in questa direzione, studiando anche altre molecole.
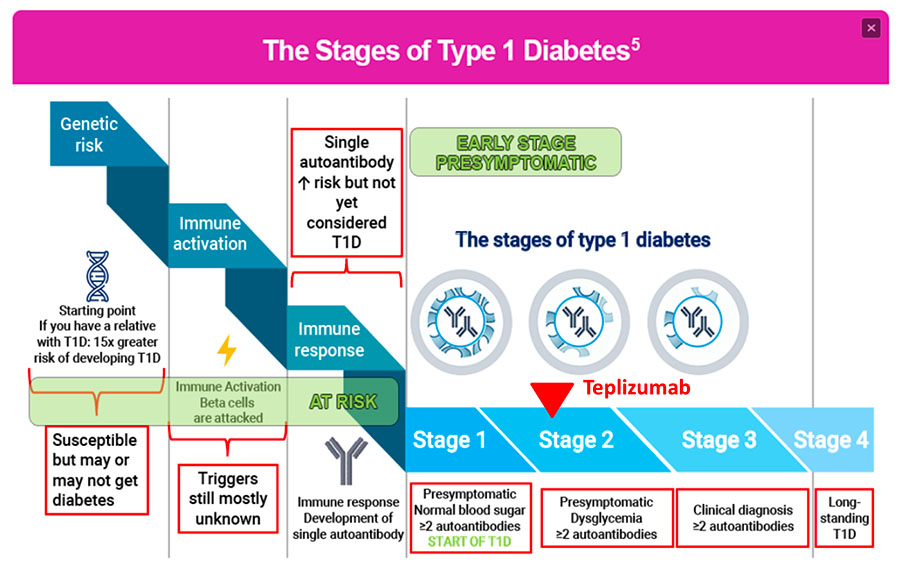
I quattro stati della storia naturale del Diabete Tipo 1 (vedi testo). Il teplizumab agisce nella fase 2 (stage 2, freccia rossa). Fonte: Rachel E J Besser, Kirstine J Bell, et al – Pediatr Diabetes 2022 Dec;23(8):1175-1187
Le 4 fasi della storia naturale del Diabete tipo 1 (T1D)
Il diabete tipo 1 è una malattia autoimmune progressiva in cui la capacità dell’organismo di regolare i livelli di zucchero nel sangue (glicemia) è compromessa a causa della graduale distruzione delle cellule beta del pancreas – produttrici di insulina – da parte del proprio sistema immunitario. La progressione del DT1 si articola in quattro fasi:
– Nella fase 1, l’attacco autoimmune alle cellule beta è iniziato e può essere rilevato dalla presenza di 2 o più autoanticorpi correlati al DT1 nel sangue. Durante la fase 1, i livelli di zucchero nel sangue sono nella norma (normoglicemia). In questa fase, il T1D è presintomatico.
– Nella fase 2 (anch’essa presintomatica), oltre alla presenza di 2 o più autoanticorpi correlati al DT1, i livelli di zucchero nel sangue risultano ormai anomali (disglicemia) a causa della progressiva perdita delle cellule beta / della funzione delle cellule beta.
È in questa fase preclinica che agisce teplizumab (vedi sotto).
– La fase 3 (nota anche come fase clinica) si manifesta una volta che una parte significativa delle cellule beta è stata distrutta. A questo punto, l’aumento dei livelli di zucchero nel sangue raggiunge il punto di iperglicemia clinica (che definisce il diabete tipo 1) e molte persone iniziano a manifestare i sintomi classici che accompagnano l’insorgenza del diabete tipo 1 di stadio 3: aumento della sete, minzione frequente, perdita di peso inspiegabile, visione offuscata e affaticamento generalizzato. La gestione del DT1 di stadio 3 richiede una terapia sostitutiva quotidiana con insulina che pesa sulla qualità della vita della persona che ne soffre.
– Lo stadio 4 è definito come DT1 autoimmune di lunga durata, spesso accompagnato da segni di complicanze diabetiche croniche, in cui la funzione delle cellule beta è ridotta o assente (si stima che la massa delle cellule beta sia ridotta fino al 95%). A questo punto, gli autoanticorpi correlati al DT1 potrebbero non essere più presenti nel sangue, poiché la maggior parte delle cellule beta è stata resa inutilizzabile dall’attacco autoimmune.
Come funziona teplizumab
Teplizumab è un anticorpo monoclonale anti-CD3 che agisce sui linfociti T implicati nella risposta autoimmune contro le cellule beta del pancreas, responsabili della produzione di insulina. Attraverso la modulazione di queste cellule immunitarie, il farmaco è in grado di rallentare la progressione autoimmune che porta alla distruzione delle cellule beta.
La somministrazione avviene tramite infusione endovenosa quotidiana per 14 giorni consecutivi, un protocollo che riflette l’effetto immunomodulante desiderato nelle prime fasi della malattia.
I risultati chiave dagli studi clinici
L’approvazione di teplizumab è basata principalmente sugli esiti dello studio di fase 2 TN-10 (ClinicalTrials.gov NCT01030861), un trial randomizzato, in doppio cieco e controllato con placebo condotto su 76 pazienti (8-45 anni) con diabete di tipo 1 in stadio 2 (presenza di almeno due autoanticorpi correlati al DT1 e disglicemia).
I risultati principali evidenziano:
- Ritardo mediano significativo nella progressione allo stadio 3 della malattia: circa 50 mesi nei pazienti trattati con teplizumab rispetto 25 mesi nel gruppo placebo.
- Riduzione del rischio di progressione clinica: al termine del follow-up, la malattia (stadio 3, diabete tipo 1 sintomatico) è stata diagnosticata in 19 (43%) dei partecipanti trattati con teplizumab e in 23 (72%) di quelli trattati con placebo.
Questi dati descrivono un effetto clinicamente significativo nel ritardare l’insorgenza della malattia.
Indicazione terapeutica e popolazione destinataria
L’approvazione europea prevede l’indicazione per:
“Ritardare l’insorgenza dello stadio 3 del diabete di tipo 1 in pazienti adulti e pediatrici di età pari o superiore a 8 anni con diagnosi di diabete di tipo 1 in stadio 2.”
La definizione di stadio 2 si basa sulla presenza di due o più autoanticorpi correlati al diabete di tipo 1 e di alterazioni della glicemia (disglicemia), pur in assenza di sintomi clinici evidenti. Intervenire in questa fase premorbosa, prima dello sviluppo della malattia conclamata e sintomatica, è il presupposto per ottenere benefici in termini di rallentamento dell’esordio.
Profilo di sicurezza del teplizumab
Nei trial clinici, il profilo di sicurezza del teplizumab è stato coerente con le aspettative di un agente immunomodulante. Gli eventi avversi più comunemente riportati includono:
- linfopenia transitoria e alterazioni ematologiche;
- rash cutaneo;
- reazioni correlate alla modulazione immunitaria (come febbre o sintomi simil-influenzali).
La somministrazione deve avvenire esclusivamente sotto supervisione specialistica, con monitoraggio adeguato, dato il meccanismo di azione sul sistema immune.
Impatto per i pazienti e il sistema sanitario
Il diabete di tipo 1 colpisce circa 2,2 milioni di persone nell’Unione Europea, con la forma sintomatica associata alla necessità di terapia insulinica quotidiana e a un significativo impatto sulla qualità di vita.
Ritardare l’insorgenza clinica del diabete tipo 1 permette non solo di posticipare l’inizio della terapia insulinica, ma anche di ridurre potenzialmente il carico psicologico e sanitario associato alla malattia conclamata, in particolare in bambini e adolescenti.
Prossimi step e accesso dei pazienti in Italia
Con l’autorizzazione della Commissione Europea, teplizumab diventa disponibile su scala UE, e i singoli Stati membri potranno avviare le procedure di valutazione prezzo-rimborso e accesso clinico.Questa approvazione segue un percorso regolatorio che ha visto anche un crescente interesse internazionale per approcci preventivi nel diabete di tipo 1, inclusi altri Paesi dove teplizumab è già stato autorizzato per la stessa indicazione.
Uso compassionevole e accesso in Italia
Va ricordato che dal 2024, Teplizumab era ed è disponibile gratuitamente dall’azienda produttrice in uso compassionevole per bambini e adolescenti che non rispondono ai trattamenti standard anche se il farmaco non ha ancora l’autorizzazione definitiva dell’Agenzia del Farmaco (AIFA) e dell’immissione in commercio (AIC). In quali tempi, questo potrà avvenire? Sarà rimborsabile, considerati gli alti costi? Al momento non è ancora noto. Si attendono ulteriori informazioni in merito.
L’importanza dello screening del diabete tipo 1
L’approvazione del teplizumab rappresenta sicuramente una grande svolta ma è solo il primo di una serie di terapie che sono attualmente in sperimentazione e che potrebbero rallentare sempre di più la progressione del diabete tipo 1, fino – forse (ovviamente questa è la speranza!) a renderne possibile la prevenzione.
Proprio per questo, non finiremo mai di sottolineare l’importanza dello screening per il diabete tipo 1 in bambini e adolescenti (Legge 130/2023).
Individuare la malattia nelle sue fasi precliniche rappresenta l’unico modo per poter intervenire precocemente, prima della diagnosi di diabete tipo 1.
Per maggiori informazioni ci si può sempre riferire alla Fondazione Italiana Diabete, FID, attiva su tutti i canali di informazione.
Leggi anche
- Diabete tipo 1: eseguita in Italia la prima infusione di Teplizumab che ne ritarda l’insorgenza »
- L’EMA raccomanda la prima terapia che ritarda l’esordio del diabete di tipo 1 »
- Screening gratuito per il diabete di tipo 1 a Milano: test aperti a tutti dal 6 al 9 novembre ‘25 »
- Congresso EASD 2025: focus su prevenzione e nuove terapie del diabete di tipo 1 »
References
- The European Commission approval of teplizumab
- Study: Teplizumab for Type 1 Diabetes Prevention In Relatives
- Press Release: Sanofi’s Teizeild approved in the EU for patients with stage 2 type 1 diabetes
- Sanofi wins EU approval for its type 1 diabetes biologic Teizeild
- Sanofi’s Teizeild approved in the EU for patients with stage 2 type 1 diabetes
- First-in-class treatment to delay onset of type 1 diabetes
Teizeild significantly delays onset of stage 3 diabetes and preserves functioning of cells producing insulin, 14 November 2025 - Meeting highlights from the Committee for Medicinal Products for Human Use (CHMP) 10-13 November 2025
- Teplizumab





