Il diabete mellito di tipo 2 è, indubbiamente, uno dei più importanti fattori di rischio per lo sviluppo di complicanze cardiovascolari. Oggi esistono numerose opzioni terapeutiche per i soggetti a maggior rischio. Tra questi quale ruolo ha il trattamento con l’insulina alla luce delle Linee Guida italiane aggiornate di recente e pubblicate dall’Associazione Medici Diabetologi (AMD) e dalla Società Italiana di Diabetologia (SID)?
Diabete di tipo 2: importante fattore di rischio di complicanze cardiovascolari
Il diabete mellito di tipo 2 è, indubbiamente, uno dei più importanti fattori di rischio per lo sviluppo di complicanze quali quelle macrovascolari1,2, e microvascolari3,4.
È ampiamente noto, in letteratura, come il rischio di malattie cardiovascolari e cerebrovascolari e di morte per tutte le cause sia significativamente ridotto nei pazienti con livelli di emoglobina glicata (HbA1c) più bassi5-11; numerosi trial che avevano come scopo quello di verificare l’importanza di un buon controllo della glicemia nella riduzione del rischio cardiovascolare del soggetto con diabete di tipo 212, hanno mostrato infatti una minore incidenza di eventi macro – e microvascolari nel gruppo di trattamento intensivo, senza tuttavia modificare la prognosi “quod vitam” della malattia diabetica12. In pratica, la riduzione della morbilità cardiovascolare, ottenuta con una terapia ipoglicemizzante maggiormente aggressiva (cioè con abbassamento di valori target di glicemia più ambiziosi), sembrava in questi studi accompagnarsi a un aumento di mortalità, come osservato in particolare in due grandi trial. 8,11
Questo sorprendente risultato trova un possibile razionale nell’eccesso di eventi ipoglicemici (totali e gravi)12,13 e nell’aumento di peso dei soggetti trattati con protocolli di terapia ipoglicemizzante aggressivi, dove l’uso di insulina e insulino secretagoghi (cioè che favoriscono la secrezione dell’insulina)12 era predominante.
L’effetto deleterio dell’ipoglicemia e dell’aumento di peso nel braccio di trattamento, piuttosto che quello del raggiungimento di target “troppo ambiziosi”, è stato chiamato in causa per spiegare questo fenomeno13,14.
Tuttavia, le ultime linee guida italiane per il trattamento dei pazienti con diabete mellito di tipo 215 sottolineano con forza l’importanza di raggiungere target glicemici più ambiziosi possibile, anche se le soglie raccomandate variano a seconda della tipologia di trattamento. Infatti:
- se per i farmaci non associati a ipoglicemie si raccomandano target di emoglobina glicata inferiori a 53 mmol/mol (7%) e si suggerisce di raggiungere 48 mmol/mol (6.5%; non è una raccomandazione forte per mancanza di trial con quella soglia);
- per l’insulina, il target proposto è rispettivamente tra 49 mmol/mol (6.6%) e 58 mmol/mol (7.5%). Infatti, mentre valori di l’HbA1c inferiori a 58 mmol/mol (7.5%) si associano a una riduzione significativa del rischio cardiovascolare, target più stringenti (inferiori a 48 mmol/mol o 6.5%), pur riducendo il rischio di complicanze microvascolari mostrano rapporti rischio-beneficio sfavorevoli a causa del maggiore rischio di ipoglicemie severe.
Le nuove linee guida italiane, pertanto, sconsigliano nei pazienti insulino-trattati il raggiungimento di target più ambiziosi12,16.
Tra i farmaci capaci di indurre ipoglicemia vengono solo di fatto nominate le sulfaniluree, in quanto al capitolo della terapia farmacologica si legge chiaramente come tale classe di farmaci, senza distinzione alcuna, non vada più considerata neanche come ultima scelta e anzi se ne raccomanda la loro deprescrizione (cessazione della prescrizione medica), indipendentemente dal compenso glicometabolico raggiunto15.
La terapia con insulina nella persona con diabete tipo 2
Il posizionamento nell’algoritmo terapeutico dell’insulina è variato molto negli anni; infatti, mentre non vi sono mai stati dubbi che la terapia con insulina vada sempre presa in considerazione nel caso di grave scompenso glicemico associato a segni di catabolismo o per valori di emoglobina glicata (HbA1c) molto elevati17, è da sempre meno chiaro se la terapia insulinica vada riservata come opzione “ultima spiaggia” o utilizzarla invece in fase più precoci della malattia, come suggerito da alcuni autori18-20 e da alcune consensus redatte da alcuni panel di esperti21,22.
Le Linee Guida moderne, tuttavia, non possono basarsi sul parere di esperti (seppur autorevoli e competenti), ma su evidenze raccolte e sintetizzate secondo la metodologia GRADE (Grading of Recommendations, Assessment, Development and Evaluation)23. Tale metodo, nato nel 2000, è oggi diventato lo strumento di riferimento per la valutazione della affidabilità delle prove scientifiche e per la formulazione di raccomandazioni cliniche basate sulle evidenze. Il GRADE ha sviluppato un approccio condiviso, sensibile e trasparente per valutare la qualità delle prove scientifiche e la forza delle raccomandazioni. Inoltre, un aspetto peculiare del sistema GRADE è l’integrazione della valutazione della qualità metodologica delle prove disponibili con altri aspetti quali: fattibilità e trasferibilità dell’intervento proposto; benefici e rischi attesi e loro rilevanza; implicazioni organizzative, economiche, sociali e finanziarie (rispetto al contesto) (Fonte: http://www.gradeworkinggroup.org/).
Da questo punto di vista, le Linee Guida italiane diabetologiche ne sono un esempio. Per cercare di capire quali dovessero essere i farmaci di prima, seconda e terza linea sono state condotte numerose metanalisi (tecnica clinico-statistica quantitativa che consente di associare i dati di più studi condotti su di una stessa tematica, generando un unico dato conclusivo per rispondere a uno o più quesito clinici specifici) e una network metanalisi con vari obiettivi (endpoint) pesati sull’importanza data dal panel nominato dalle due linee guida (SID e AMD), ovvero:
- complicanze macrovascolari e mortalità (9 punti su 10);
- ipoglicemie severe (8/10);
- emoglobina glicata (HbA1c) a lungo termine e qualità della vita (7/10), ecc.
Dai risultati di queste metanalisi riportati nella recente pubblicazione su “Il Diabete”15, ne conseguono le raccomandazioni che indicano, per quanto riguarda l’insulina, come questa sia sempre da considerare come ultima scelta sia per la minore efficacia a lungo termine sulla HbA1c e per il maggior rischio ipoglicemico rispetto agli altri farmaci, che per la sua neutralità nella prevenzione delle complicanze macro e microvascolari. Tale posizionamento nell’algoritmo terapeutico si mantiene in tutte le categorie di pazienti individuate, ovvero sia nei pazienti con, che in quelli senza storia di pregresse malattie cardiovascolari (Figura n.1).
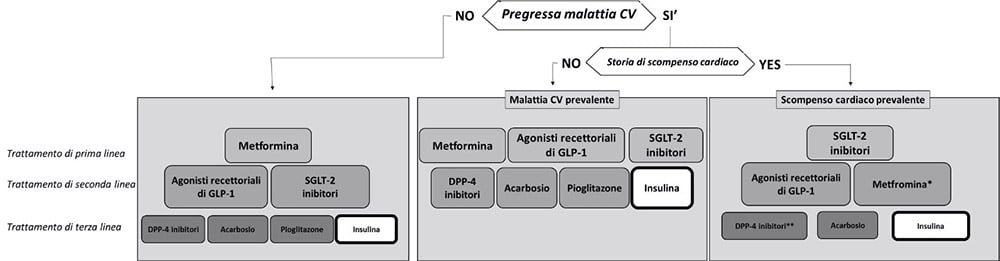
Algoritmo terapeutico del trattamento farmacologico del diabete di tipo 2. (*Solo per pazienti in classe NYHA I e II; **escluso saxagliptin).
Tipologia di insulina: diversi schemi terapeutici nel diabete tipo 2
Un altro punto molto dibattuto è da sempre quello sugli schemi terapeutici nel diabete di tipo 2 (insulina basale vs. prandiale19,21, insulina multi-iniettiva vs pompa d’infusione24,25) e sulle varie tipologie di insulina (insulina umana vs. analoghi, differenti tipi di analoghi dell’insulina rapidi e lenti26).
La spinta della ricerca e del mercato in questo campo è stata negli ultimi vent’anni molto importante con l’avvento di nuovi analoghi dell’insulina sempre più rapidi o con azione sempre più prolungata e stabile nel tempo. A tale impulso, tuttavia, non sempre le linee guida e le raccomandazioni esistenti sono state rigorose (e limpide) nel guidare la scelta del clinico. In parte, sempre per la mancanza di una metodologia condivisa e scientificamente valida sulla redazione delle raccomandazioni, in parte per la scelta di obiettivi (endpoint) non sempre adeguati, quali ad esempio l’efficacia intesa come riduzione della HbA1c (spesso considerata a breve termine), anziché la riduzione del rischio ipoglicemico.
Infatti, negli ultimi decenni, gli studi clinici hanno quasi sempre adottato disegni del tipo “intention-to-treat” (analisi dei dati di tutti i pazienti sulla base della loro assegnazione iniziale ai gruppi, indipendentemente da come si sia poi evoluta la loro partecipazione alla sperimentazione, fonte: Istituto Superiore di Sanità), dove i protocolli tendevano il più possibile ad ottenere in entrambi i gruppi di trattamento gli stessi target glicemici. Questo ha di fatto livellato le differenze tra le varie molecole e schemi terapeutici rendendo ancor più difficoltosa una valutazione delle evidenze.
Il panel di Esperti incaricato di redigere le nuove Linee Guida diabetologiche italiane ha pertanto deciso di scegliere accuratamente gli obiettivi (endpoint) “critici”, selezionando tutti gli studi clinici randomizzati che avessero come durata minima almeno 52 settimane e categoria di riferimento glargine U100 per quanto riguarda le insuline basali e l’insulina regolare umana per le insuline prandiali. Dopodiché ha effettuato una network metaanalysis o metanalisi “a rete” – un nuovo strumento di analisi delle evidenze che offre l’importante vantaggio di “inglobare” in un’unica analisi tutte le evidenze disponibili – per verificare la superiorità di una insulina rispetto ad un’altra.
I risultati di questa importante revisione sistematica della letteratura non hanno evidenziato significative differenze tra i vari analoghi dell’insulina basali e prandiali, tali da far preferire una molecola rispetto ad un’altra, mentre il confronto tra analoghi dell’insulina e insuline umane, ha chiaramente mostrato una maggiore sicurezza di impiego delle prime sulle seconde. Le attuali raccomandazioni ribadiscono infatti la necessità di:
- bandire definitivamente le insuline umane anche dagli algoritmi terapeutici del diabete di tipo 2 (pazienti ambulatoriali)26.
L’uso di microinfusori di insulina nei pazienti con diabete tipo 2
Infine, come ultimo quesito sulla terapia insulinica, il panel di Esperti ha affrontato il problema dell’opportunità di utilizzare le pompe d’infusione (microinfusori) anche nel paziente con tipo 2. I dati in letteratura sono ancora molto limitati e non emerge un chiaro vantaggio delle pompe d’infusione insulinica (microinfusori) rispetto alla terapia muiltiniettiva, anche nei pazienti con diabete di tipo 2 e scompenso glicometabolico, a fronte di una spesa maggiore. Al momento, pertanto, l’uso dei microinfusori nel diabete di tipo 2 è confinato solo a casi molto selezionati e ne viene sconsigliato un uso più estensivo 24.
Conclusioni
In conclusione, se si eccettuano i casi di grave scompenso glicometabolico, la terapia insulinica dovrebbe essere sempre considerata come ultima scelta:
- sia per la minore efficacia a lungo termine sull’emoglobina glicata (HbA1c) e per il maggior rischio ipoglicemico rispetto agli altri farmaci;
- sia per la sua neutralità nella prevenzione delle complicanze macrovascolari e microvascolari.
- Inoltre, le formulazioni di insulina umana non dovrebbero essere più prescritte e sempre sostituite, indipendentemente dal controllo della glicemia, con analoghi dell’insulina, senza preferenze chiare tra una molecola rispetto a un’altra.
- Infine, l’uso dei microinfusori nel paziente di tipo 2 è da considerarsi una opzione terapeutica solo in casi molto selezionati e non in tutti i pazienti che falliscono alla terapia multi-iniettiva.
Leggi anche
Terapia del diabete mellito tipo 2: pubblicate le nuove Linee Guida AMD-SID »
References
- Beckman JA, Creager MA, Libby P – Diabetes and atherosclerosis: epidemiology, pathophysiology, and management. Jama 2002;287(19):2570-81
- Sarwar N, Gao P, Seshasai SR, et al – Diabetes mellitus, fasting blood glucose concentration, and risk of vascular disease: a collaborative meta-analysis of 102 prospective studies. Lancet 2010;375(9733):2215-22
- Pugliese G, Penno G, Natali A, et al – Diabetic kidney disease: New clinical and therapeutic issues. Joint position statement of the Italian Diabetes Society and the Italian Society of Nephrology on “The natural history of diabetic kidney disease and treatment of hyperglycemia in patients with type 2 diabetes and impaired renal function”. Nutrition, metabolism, and cardiovascular diseases : NMCD 2019;29(11):1127-1150
- Sabanayagam C, Banu R, Chee ML, et al – Incidence and progression of diabetic retinopathy: a systematic review. Lancet Diabetes Endocrinol 2019;7(2):140-149
- Effect of intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes (UKPDS 34). UK Prospective Diabetes Study (UKPDS) Group. Lancet (London, England) 1998;352(9131):854-65
- Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). UK Prospective Diabetes Study (UKPDS) Group. Lancet (London, England) 1998;352(9131):837-53
- Dormandy JA, Charbonnel B, Eckland DJ, et al – Secondary prevention of macrovascular events in patients with type 2 diabetes in the PROactive Study (PROspective pioglitAzone Clinical Trial In macroVascular Events): a randomised controlled trial. Lancet (London, England) 2005;366(9493):1279-89
- Duckworth W, Abraira C, Moritz T, et al. Glucose control and vascular complications in veterans with type 2 diabetes. The New England journal of medicine 2009;360(2):129-39
- Ohkubo Y, Kishikawa H, Araki E, et al. Intensive insulin therapy prevents the progression of diabetic microvascular complications in Japanese patients with non-insulin-dependent diabetes mellitus: a randomized prospective 6-year study. Diabetes research and clinical practice 1995;28(2):103-17
- Patel A, MacMahon S, Chalmers J, et al. Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes. The New England journal of medicine 2008;358(24):2560-72
- Gerstein HC, Miller ME, Genuth S, et al. Long-term effects of intensive glucose lowering on cardiovascular outcomes. N Engl J Med 2011;364(9):818-28
- Mannucci E, Monami M, Lamanna C, Gori F, Marchionni N. Prevention of cardiovascular disease through glycemic control in type 2 diabetes: a meta-analysis of randomized clinical trials. Nutrition, metabolism, and cardiovascular diseases : NMCD 2009;19(9):604-12
- Seaquist ER, Miller ME, Bonds DE, et al. The impact of frequent and unrecognized hypoglycemia on mortality in the ACCORD study. Diabetes Care 2012;35(2):409-14
- Basu S, Raghavan S, Wexler DJ, Berkowitz SA. Characteristics Associated With Decreased or Increased Mortality Risk From Glycemic Therapy Among Patients With Type 2 Diabetes and High Cardiovascular Risk: Machine Learning Analysis of the ACCORD Trial. Diabetes Care 2018;41(3):604-612
- Mannucci E, Candido R, delle Monache L, et al. Linee Guida per la terapia del diabete mellito di tipo 2. Il Diabete Online 2021;33(3)
- Monami M, Candido R, Pintaudi B, Targher G, Mannucci E. Improvement of glycemic control in type 2 diabetes: A systematic review and meta-analysis of randomized controlled trials. Nutrition, metabolism, and cardiovascular diseases : NMCD 2021;31(9):2539-2546
- Davies MJ, D’Alessio DA, Fradkin J, et al. Management of Hyperglycemia in Type 2 Diabetes, 2018. A Consensus Report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care 2018;41(12):2669-2701
- Bolli GB, Consoli A, Giaccari A. Early insulin treatment in type 2 diabetes: ORIGINal sin or valuable choice as ORIGINal treatment? An open debate on the ORIGIN study results. Nutrition, metabolism, and cardiovascular diseases : NMCD 2012;22(12):1007-12
- Dailey G. Optimum management of type 2 diabetes–timely introduction, optimization and intensification of basal insulin. Diabetes, obesity & metabolism 2008;10 Suppl 2:5-13
- Hanefeld M, Bramlage P. Insulin use early in the course of type 2 diabetes mellitus: the ORIGIN trial. Curr Diab Rep 2013;13(3):342-9
- Nathan DM, Buse JB, Davidson MB, et al. Management of hyperglycemia in type 2 diabetes: A consensus algorithm for the initiation and adjustment of therapy: a consensus statement from the American Diabetes Association and the European Association for the Study of Diabetes. Diabetes Care 2006;29(8):1963-72
- Shah S, Sharma SK, Singh P, Muruganathan A, Das AK. Consensus evidence-based guidelines for insulin initiation, optimization and continuation in type 2 diabetes mellitus. J Assoc Physicians India 2014;62(7 Suppl):49-54
- Guyatt GH, Oxman AD, Santesso N, et al. GRADE guidelines: 12. Preparing summary of findings tables-binary outcomes. J Clin Epidemiol 2013;66(2):158-72
- Dicembrini I, Mannucci E, Monami M, Pala L. Impact of technology on glycaemic control in type 2 diabetes: A meta-analysis of randomized trials on continuous glucose monitoring and continuous subcutaneous insulin infusion. Diabetes, obesity & metabolism 2019;21(12):2619-2625
- Dicembrini I, Pala L, Caliri M, et al. Combined continuous glucose monitoring and subcutaneous insulin infusion versus self-monitoring of blood glucose with optimized multiple injections in people with type 1 diabetes: A randomized crossover trial. Diabetes, obesity & metabolism 2020;22(8):1286-1291
- Mannucci E, Caiulo C, Naletto L, Madama G, Monami M. Efficacy and safety of different basal and prandial insulin analogues for the treatment of type 2 diabetes: a network meta-analysis of randomized controlled trials. Endocrine 2021