Con la consulenza del prof. Claudio Cobelli**, Professore Emerito di Bioingegneria dell’Università di Padova
Pancreas artificiale: che cos’è? Quali sono i suoi componenti? Come funziona? La sua funzione è sovrapponibile a quella fisiologica delle cellule beta delle isole di Langherans del pancreas? Esistono diversi tipi di pancreas artificiale? Quali sono i limiti attuali del pancreas artificiale? A queste domande risponde di seguito il Prof Claudio Cobelli, che sta lavorando al progetto Forget Diabetes (“Dimentica il diabete”) di cui parliamo in un altro articolo (link in fondo).
1. Pancreas artificiale: che cosa s’intende?
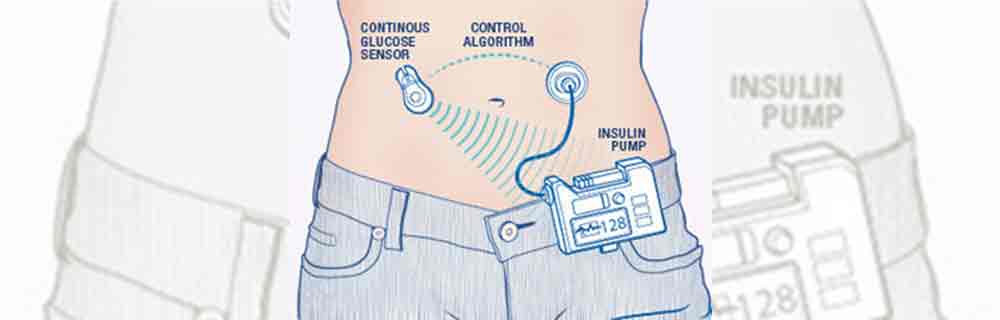
Il pancreas artificiale – definito in termini tecnici: sistema di controllo della glicemia ad ansa chiusa “closed-loop system” – è un sistema integrato in continua evoluzione che ha l’obiettivo di sostituire la funzione endocrina del pancreas, che è compromessa nei pazienti con diabete, in particolare nei soggetti con diabete tipo 1. Il pancreas artificiale è un complesso di una pompa per l’infusione sottocutanea “automatica” di insulina sulla base della concentrazione di glucosio del momento, misurata in continuo da un sensore nel fluido interstiziale (non esistono in commercio sistemi ad infusione e.v.).
2. Quali sono i componenti base del pancreas artificiale?
Il sistema è composto da tre elementi principali, connessi in modalità wireless:
- un sensore sottocutaneo per la lettura in continuo del glucosio;
- un microinfusore per la somministrazione di insulina;
- un algoritmo di controllo che può essere integrato con il microinfusore o essere associato a un’unità separata, per esempio un telefono. L’algoritmo è l’elemento chiave per il funzionamento del pancreas artificiale in quanto determina la quantità di insulina da infondere sottocute in un paziente sulla base del valore di glucosio registrato dal sensore nel fluido interstiziale. Nel tempo sono stati proposti diversi algoritmi ma sono due ad essere comunemente usati: il PID (Proportional-Integral-Derivative) e l’MPC (Model Predictive of Control).
La maggior parte degli algoritmi di controllo contiene moduli di sicurezza finalizzati ad evitare un’infusione eccessiva di insulina.
3. La funzione del pancreas artificiale è sovrapponibile a quella delle cellule beta delle isole pancreatiche?
Allo stato attuale, la performance del pancreas artificiale è inferiore a quella delle cellule beta pancreatiche; questo perché l’insulina iniettata sottocute dal microinfusore agisce in ritardo rispetto all’insulina rilasciata fisiologicamente nel circolo portale (vena porta) che passa direttamente per il fegato, cosa che non avviene con l’insulina somministrata sottocute. Nella differente prestazione entrano in gioco anche limiti correlati all’efficienza del sensore che rileva la concentrazione di glucosio nel fluido interstiziale e non direttamente nel sangue arterioso (vedi figura).
4. Il Pancreas artificiale come funziona?
Il pancreas artificiale migliora la vita dei pazienti con diabete tipo 1 che non sono più costretti a controllare manualmente il livello di glicemia nel sangue più di 10 volte al giorno.
L’uso di un sistema ad ansa chiusa (closed-loop) consente alla persona con diabete tipo 1 di delegare al sistema lo sgradito compito di iniettarsi insulina ogni giorno; è il pancreas artificiale che lo fa, regolando in autonomia il livello di zuccheri nel sangue, ovvero abbassandoli quando il sensore li rileva troppo alti (picchi di iperglicemia) e non facendoli scendere ulteriormente se tendono ad abbassarsi troppo (picchi di ipoglicemia). In definitiva, consente di ottenere un miglior controllo della glicemia e un time in range superiore (si stima un aumento di circa due ore e mezza ogni giorno di glicemia in un range normale in confronto agli altri trattamenti) obiettivo da considerarsi rilevante per ridurre il rischio di complicanze diabetiche croniche e per evitare i temuti episodi di ipoglicemia.
5. Esistono diversi tipi di pancreas artificiale?
Ad oggi, esistono due sistemi principali di Automated-Insulin Delivery (AID) Systems o closed-loop (o “catena chiusa”), il più diffuso definito “hybrid closed-loop” e quello definito “full closed-loop”.
Il sistema ibrido consente di controllare in modo automatico l’infusione sottocutanea di insulina basale ma richiede l’intervento manuale al momento del pasto: il paziente deve inserire nel sistema informazioni sull’introito di carboidrati del singolo pasto (calcolo dei carboidrati o conta CHO) e confermare le unità di bolo di insulina calcolate dal sistema. I sistemi ibridi attualmente in uso mostrano la massima efficacia lungo il digiuno notturno, garantendo circa l’80% del tempo del glucosio tra i 70 e i 180 mg/dl (Time In Range, TIR), superando di oltre 10 punti in percentuale i primi sistemi integrati microinfusore-sensore (Sensor Augmented Pump, SAP).
I sistemi ibridi closed-loop attualmente in commercio sono mono-ormonali ovvero infondono in via sottocutanea solo insulina ma già dal 2014 si stanno sperimentando con ottime prospettive sistemi bi-ormonali closed-loop che utilizzano due ormoni: insulina e glucagone. Gli studi in corso hanno confermato l’efficacia di questi sistemi e la superiorità sia rispetto alla terapia con microinfusore che con sistema ibrido mono-ormonale (insulina s.c.) in particolare nel prevenire episodi di ipoglicemia in corso o dopo attività fisica o boli prandiali,
Il pancreas artificiale completo è totalmente automatico, non richiede quindi interventi da parte del paziente ma compensa in modo automatico gli effetti di ogni pasto (e di ogni altro fattore condizionante: attività fisica, stress, ciclo mestruale etc) in relazione all’impatto che esso determina sulla concentrazione di glucosio nel sangue (glicemia). Al momento attuale, l’infusione sottocutanea di insulina garantita dal microinfusore non è così rapida da poter garantire un buon controllo in tutte le situazioni. Proprio per questo vengono al momento utilizzati soprattutto modelli ibridi anche se la sperimentazione con quelli completi continua.
6. Quali sono i limiti attuali del pancreas artificiale?
I sistemi closed-loop attualmente disponibili mostrano ancora alcuni limiti tecnici che gli addetti ai lavori stanno cercando costantemente di migliorare. Facciamo alcuni esempi:
- ritardo nell’assorbimento dell’insulina iniettata sottocute con conseguente ritardo dell’inizio dell’azione farmacologica rispetto alle necessità e limitazioni al controllo glicemico ai pasti e durante l’attività fisica;
- complessità del sistema [in particolare per i sistemi bi-ormonali – a oggi ancora sperimentali – che oltre all’insulina infondono anche glucagone;
- scarsa accettazione nel tempo da parte del paziente con diabete che deve “indossare” più dispositivi, sostituire ogni giorno l’insulina e risolvere eventuali problemi tecnici, sia di connessione che meccanici. Al momento non ci sono studi sull’impatto psicologico dei nuovi sistemi;
- necessità di intervento della persona con diabete per l’erogazione del bolo e stima della quantità dei carboidrati del pasto (sistemi ibridi).
Ci sono sicuramente ancora molti passi avanti da fare per realizzare un pancreas artificiale pienamente soddisfacente e disponibile su larga scala a costi sostenibili dal Sistema Sanitario ma ogni giorno possiamo considerarci più vicini all’obiettivo.
Leggi anche
References
- Anderson SM, Dassau E, Raghinaru D, Lum J, Brown SA, Pinsker JE, Church MM, Levy C, Lam D, Kudva YC, Buckingham B, Forlenza GP, Wadwa RP, Laffel L, Doyle FJ 3rd, DeVries JH, Renard E, Cobelli C, Boscari F, Del Favero S, Kovatchev BP – The International Diabetes Closed-Loop Study: Testing Artificial Pancreas Component Interoperability. Diabetes Technol Ther 2019 Feb;21(2):73-80
- Messori M, Toffanin C, Del Favero S, De Nicolao G, Cobelli C, Magni L – Model individualization for artificial pancreas. Comput Methods Programs Biomed 2019 Apr;171:133-140
- Bekiari E, Kitsios K, Thabit H, Tauschmann M, Athanasiadou E, Karagiannis T, Haidich AB, Hovorka R, Tsapas A – Artificial pancreas treatment for outpatients with type 1 diabetes: systematic review and meta-analysis. BMJ 2018 Apr 18;361:k1310
- Kovatchev, B – The year of transition from research to clinical practice. Nat Rev Endocrinol14, 74–76 (2018)
- Thabit H, Hovorka R – Coming of age: the artificial pancreas for type 1 diabetes. Diabetologia 2016 Sep;59(9):1795-805
- Renard E, Cobelli C, Kovatchev BP – Closed loop developments to improve glucose control at home. Diabetes Res Clin Pract 2013 Nov;102(2):79-85
- Renard E, Cobelli C, Zisser HC, Kovatchev BP – Artificial pancreas goes outpatient: a new diabetes ecosystem. J Diabetes Sci Technol 2013 Nov 1;7(6):1411-5
- Cobelli C, Renard E, Kovatchev B – Artificial pancreas: past, present, future. Diabetes 2011 Nov;60(11):2672-82
- Francis J. Doyle III, Lauren M Huyett, Joon Bok Lee, Howard C. Zisser and Eyal Dassau – Closed-Loop Artificial Pancreas Systems: Engineering the Algorithms. Diabetes Care 2014 May; 37(5): 1191-1197
** Claudio Cobelli è professore emerito di Bioingegneria presso l’Università di Padova. Dal 2000 al 2011 è stato presidente dei Corsi di Studio di Ingegneria Biomedica e del Dottorato di Ricerca di Bioingegneria.
La sua principale attività di ricerca è nel campo della modellistica e identificazione di sistemi fisiologici, in particolare del sistema glucosio-insulina nel diabete. La sua ricerca è attualmente supportata da NIH, JDRF e Comunità Europea.
Ha pubblicato 565 articoli su riviste internazionali con referee, co-autore di 8 libri e detiene 10 brevetti con un h-index di 83 (Scopus) e 104 (Google). Attualmente è Associate Editor di IEEE Transaction on Biomedical Engineering e Journal of Diabetes Science & Technology.
Fa parte dell’Editorial Board di Diabetes Technology & Therapeutics.
Cobelli è stato presidente (1999-2004) dell’Italian Biomedical Engineering Group, president (1990-1993 e 1993-1996) dell’IFAC TC on Modeling and Control of Biomedical Systems e membro dell’IEEE EMBS AdCom Member (2008-2009). È membro (2019-2022) del Consiglio Superiore di Sanità del Ministero della Salute italiano. Nel 2010 ha ricevuto il Diabetes Technology Artificial Pancreas Research Award. È Fellow di IEEE e BMES.