NEURODIAB 2018, Congresso internazionale sulla neuropatia diabetica, una complicanza che colpisce 1 su 3 persone con diabete. Nel corso del congresso, che si è svolto a Roma, il 4-7 settembre 2018, sono stati presentati i nuovi strumenti di diagnosi e si è fatto il punto sulle ultime terapie disponibili. NEURODIAB, il Gruppo di Studio sulla Neuropatia Diabetica della Società Europea per lo Studio del Diabete (EASD, European Society for the Study of Diabetes), è presieduto dalla d.ssa Simona Frontoni, professoressa di Endocrinologia presso l’Università Tor Vergata di Roma e Presidente della sezione Lazio della Società Italiana di Diabetologia (SID).
Tanti sintomi diversi, un impatto importante sulla qualità di vita
“Dottore, ho sempre la sensazione di un formicolio ai piedi…”, “Io sento un dolore bruciante alle gambe, come delle frustate, non mi lascia più!”, “per me mangiare un pasto intero è praticamente diventato impossibile… il mio stomaco si rifiuta di ricevere cibo, oppure lo vomito quasi subito; non parliamo della digestione, un’impresa lunga ore.”, “io faccio fatica a parlarne con il dottore, mi vergogno… la mia vita sessuale è devastata e non so neppure bene perché…” ; “mio marito ha sempre l’umore nero e poi tende a cadere, quasi senza accorgersene… mi fa stare sempre in ansia!”. Tante manifestazioni diverse, e non sono le sole, tutte con un impatto significativo sulla qualità di vita di chi ha il diabete e di chi gli sta vicino; condizioni e disturbi che per molte persone con diabete di lunga data sono una compagnia quotidiana, della quale spesso non parlano, sopportandola in silenzio. Ma questa costellazione di sintomi, in apparenza così diversi e lontani tra loro un nome ce l’ha: ‘neuropatia diabetica’, una complicanza a lungo termine che colpisce 1 su 3 persone con diabete e che ha un decorso subdolo perché può evolvere per anni senza dare segni di sé. Per questo è importante la diagnosi precoce: per rallentarne l’evoluzione.
Neuropatia diabetica: che cos’è?
“La neuropatia diabetica – ha spiegato la prof.ssa Simona Frontoni – fa parte delle complicanze croniche del diabete e interessa quasi tutti gli organi e apparati. Si distingue in una forma periferica e in una forma autonomica. La neuropatia periferica interessa i nervi periferici (→ vedi illustrazione), soprattutto degli arti inferiori; la neuropatia autonomica interessa l’innervazione simpatica e vagale (→ vedi illustrazione) del nostro organismo e in quanto tale va a colpire quasi tutti gli organi. La forma più importante e pericolosa di neuropatia autonomica è quella cardiovascolare, in quanto è responsabile di un’altissima percentuale di mortalità e morbilità tra le persone con diabete, proprio perché colpisce la regolazione autonomica del cuore e della pressione arteriosa. La neuropatia autonomica può interessare anche il sistema gastrointestinale e quello uro-vescicale”.
Esiste anche una forma di neuropatia ‘centrale’
“Negli ultimi anni, abbiamo scoperto – prosegue la prof.ssa Frontoni – che il sistema nervoso centrale è in qualche modo coinvolto nella neuropatia autonomica. Nel corso del congresso sono stati presentati dei dati del gruppo del prof. Solomon Tesfaye (Sheffield Teaching Hospital and the University of Sheffield, UK) che dimostrano come esista una grossa componente centrale, per esempio nella percezione del dolore. Anche nel caso dell’Alzheimer che è molto frequente nel paziente con diabete sappiamo che esistono delle strette correlazioni tra la forma di neuropatia centrale e quella periferica. E’ ormai conoscenza acquisita che l’Alzheimer sia un’ importante complicanza del diabete di tipo 2: al congresso il prof. Rafael Simò (Barcellona) ha presentato un dato molto interessante sulla possibilità di predire la comparsa di Alzheimer nella persona con diabete, attraverso lo studio delle alterazioni della retina, evidenziate dalla microperimetria retinica.”
Che cosa provoca la neuropatia diabetica? In primis iperglicemia, stress ossidativo, infiammazione e aumento di cellule ‘gregario’
Come tutte le complicanze croniche del diabete, anche la neuropatia è conseguenza dell’iperglicemia; in particolare, molto pericolosi sono gli ‘sbalzi’ di glicemia, soprattutto se frequenti, cioè la cosiddetta variabilità glicemica. Un’elevata variabilità glicemica è il principale responsabile dello sviluppo di neuropatia. Come avviene tutto ciò? Attraverso meccanismi prevalentemente legati all’innesco dello stress ossidativo o di processi pro-infiammazione o per l’alterazione dei microvasi che portano nutrimento ai nervi. Tutti questi meccanismi vanno a danneggiare le fibre nervose (infiammazione persistente e stress ossidativo) fino alla morte delle stesse (apoptosi). Oggi sappiamo che il danno mielinico è molto precoce; la mielina è una guaina lipidica isolante (un po’ come il manicotto di plastica dei fili elettrici) che circonda la maggior parte delle fibre nervose (assoni) e permette di garantire un’alta velocità di trasmissione dell’impulso nervoso all’interno del nostro corpo.
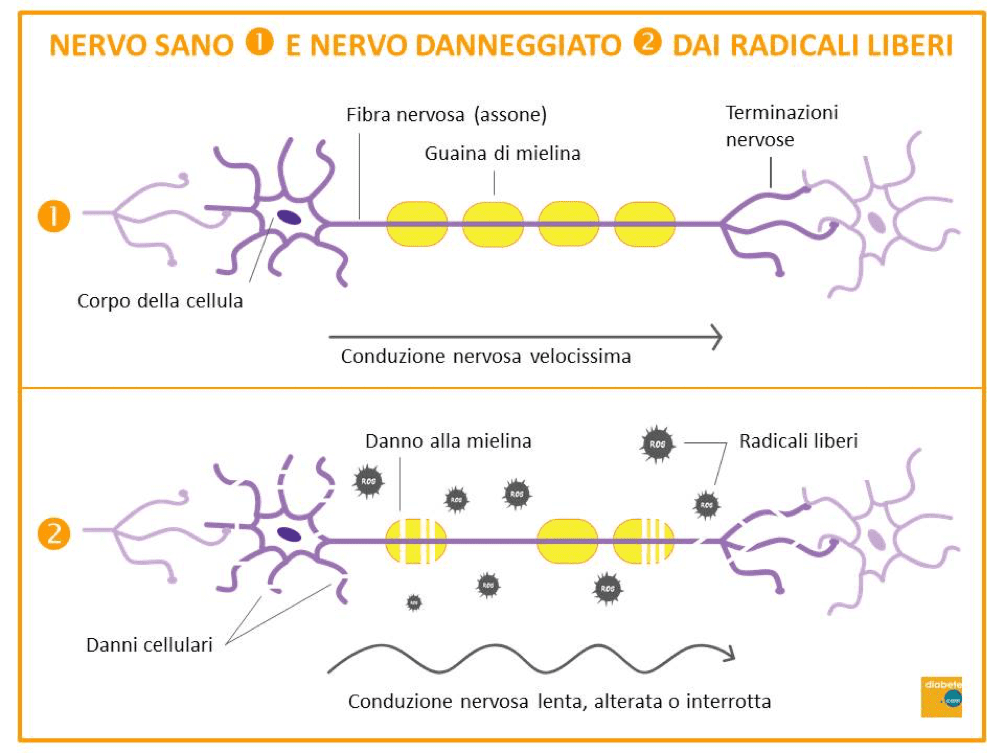
“Un’altra acquisizione recente è che le cellule gliali (cellule che forniscono un supporto strutturale e metabolico ai neuroni, presenti in numero notevolmente superiore a questi ultimi) sembrano avere un ruolo importante nella precocità del danno nervoso, perché sono quelle che in qualche modo garantiscono il nutrimento e le informazioni alle cellule nervose (neuroni). In uno studio che stiamo effettuando sulla retina – ha continuato la prof. Frontoni – abbiamo dimostrato che le cellule di Müller (l’equivalente nella retina delle cellule gliali del tessuto nervoso) sono implicate in alterazioni estremamente precoci alle quali segue il danno della cellula nervosa. Le cellule gliali insomma, ritenute fino a poco tempo fa una sorta di impalcatura inerte, sono al contrario delle vere e proprie cellule ‘gregario’ per i nervi. Se la retina è danneggiata da stress ossidativo provocato da sbalzi glicemici frequenti, queste cellule si attivano per cercare di proteggere le cellule nervose”.
Nonostante l’incidenza, pochi ne parlano e molto dopo l’inizio dei disturbi
Secondo gli ultimi dati epidemiologici, forniti dal prof. Andrea Truini, dell’Università La Sapienza di Roma, il 36 per cento delle persone con diabete presenta una polineuropatia (prevalenza riferita all’Italia, ma simile alla situazione di altri Paesi Europei, come Francia e Gran Bretagna) e il 13 per cento una polineuropatia dolorosa. Purtroppo, la conoscenza di questi disturbi, da parte degli stessi pazienti, dell’opinione pubblica e di molti medici, è ancora scarsa. Questo fa sì che il paziente tenda a non parlare dei propri sintomi (tranne in casi estremi), se non adeguatamente sollecitato dal medico e dunque non riceva una diagnosi precoce e delle terapie che potrebbero alleviarli.
La buona notizia: la possibilità di una diagnosi precoce
Oggi è possibile diagnosticare precocemente la neuropatia diabetica. “Per prima cosa – sottolinea la prof.ssa Frontoni – è importante saperla riconoscere attraverso i suoi segni e sintomi.
NEUROPATIA AUTONOMICA
Nel caso della neuropatia autonomica, alcuni di questi sono piuttosto precoci e – anche se aspecifici – se ben inquadrati nel contesto clinico possono aiutarci a porre un sospetto diagnostico. Ad esempio, uno dei primi segni e sintomi della neuropatia diabetica è la disfunzione erettile (che nel diabetico può avere anche cause vascolari ma che spesso nasconde anche una neuropatia).
Sintomi gastro-intestinali, quali un rallentato svuotamento gastrico che dà un senso di ripienezza, può essere un iniziale segno di neuropatia gastro-intestinale, fino alla gastroparesi.
La presenza di una tachicardia fissa e di una scarsa modulazione della frequenza cardiaca è un altro segno da valorizzare nella diagnosi; più avanti nel tempo compare l’ipotensione ortostatica [brusco calo della pressione sanguigna (> 20 mmHg PAS; > 10 mmHg PAD) quando si passa in modo repentino dalla posizione seduta o sdraiata (clinostatismo) a quella eretta (ortostatismo)] che è un segno importante, facile da individuare e che è fortemente diagnostico di neuropatia diabetica. Purtroppo, bisogna anche ricordare che l’ipotensione ortostatica si associa anche a un aumento di mortalità e morbilità nella popolazione con diabete. Altro motivo per ricercarne attivamente la presenza.
NEUROPATIA PERIFERICA
Per la neuropatia periferica è molto importante l’esame del paziente, l’ispezione regolare del piede, la valutazione del polso e il test del microfilamento che insieme consentono di fare agevolmente diagnosi di neuropatia diabetica periferica, senza necessità di ricorrere ad esami quali l’elettromiografia (EMG), necessaria solo quando si vuole fare una diagnosi differenziale dalla neuropatia diabetica.
Il test del microfilamento
Il test del microfilamento è un esame molto semplice da eseguire, che il medico effettua toccando alcune parti predefinite del dorso e della pianta del piede del paziente con un microfilamento (una sorta di setola semi-rigida, vedi foto sotto). È un test indolore, decisamente low-cost e alla portata di ogni medico. L’esame rileva la percezione del filamento a livello del piede, da parte del paziente con diabete e ne valuta, quindi, la sensibilità periferica. La perdita della percezione del microfilamento è considerata un indice estremamente precoce di neuropatia diabetica, oltre che un indice prognostico negativo per piede diabetico (complicanza in stretta correlazione con la neuropatia).

I nuovi test diagnostici
- Holter cardiaco e analisi spettrale. Per la neuropatia autonomica cardio-vascolare esistono dei nuovi test molto sofisticati. Oggi è possibile utilizzare l’analisi spettrale dell’intervallo R-R all’Holter cardiaco che consente di fare una diagnosi di neuropatia autonomica più precoce e sofisticata.
- Microperimetria retinica. Si esegue dall’oculista, è un esame di Tomografia Ottica Computerizzata (OCT) che permette di misurare alcuni spessori della retina. “Per troppo tempo – ha ammesso la prof.ssa Frontoni – la retinopatia diabetica è stata considerata solo una complicanza microvascolare; in realtà, se andiamo ad esaminare il tessuto retinico vediamo che questo è costituito per lo più da cellule nervose, mentre la componente vascolare è molto meno rappresentata (anche se è più facile da esaminare, ad esempio attraverso il fondo dell’occhio che permette lo studio dei vasi retinici). Di fatto insomma la retina è tessuto nervoso. E questo ha naturalmente implicazioni importanti, perché attraverso la misurazione degli strati retinici con l’OCT e anche attraverso la misurazione della funzione retinica con il multi-focal ERG (MFERG) che è un test funzionale di trasmissione dell’impulso nervoso della retina, si sono cominciate a fare correlazioni tra queste alterazioni retiniche e l’Alzheimer, ma anche con la neuropatia periferica.
- Microscopia confocale corneale. La esegue sempre l’oculista e permette di individuare molto precocemente la neuropatia periferica perché le fibre della cornea sono delle piccole fibre e si ritiene che siano le prime ad essere alterate nella neuropatia. La microscopia confocale della cornea è un esame che, come il Sudoscan (vedi sotto) consente di valutare precocemente le alterazioni delle piccole fibre. In questo caso, quelle della cornea. Queste alterazioni precoci sono predittive poi di comparsa di neuropatia periferica.
- Sudoscan (conduttanza cutanea elettrochimica). È un esame che viene utilizzato anche nelle forme di neuropatia pre-diabetica. Il Sudoscan sfrutta una metodica che va ad indagare le alterazioni delle piccole fibre nervose, considerate alterazioni precoci della neuropatia che – analogamente a quanto visto per la cornea – sono le prime alterazioni che si manifestano. Il Sudoscan esiste da un certo numero di anni, ed è un test validato in grado di rivelare alterazioni precoci (anche nel soggetto con prediabete). Si esegue in varie parti del corpo (palmo delle mani, piante dei piedi, etc); è una sorta di cuscinetto che si mette a contatto con la cute del paziente e che si colora quando viene a contatto col sudore. Le ghiandole sudoripare, che sono innervate dalle piccole fibre, rappresentano una spia di un’alterazione precoce di questa innervazione. Col Sudoscan si misura la capacità della ghiandola sudoripara di una specifica area di rilasciare ioni cloro, dopo aver somministrato un piccolissimo stimolo elettrico nella zona in esame. Nel soggetto con diabete, la quantità rilasciata è ridotta per le alterazioni a carico dell’innervazione delle ghiandole sudoripare.
I progressi della terapia, le molecole più efficaci
“La terapia migliore e più efficace in assoluto della neuropatia diabetica – afferma la prof.ssa Frontoni – è lo stretto controllo metabolico del diabete. Per la neuropatia periferica, ci sono dati interessanti sull’utilizzo di alcuni integratori, quali l’acido alfa-lipoico (ALA) che, se assunto per lunghi periodi può dare risultati, soprattutto se iniziato precocemente. L’acido alfa-lipoico (ALA) è stato utilizzato anche nella neuropatia autonomica, ma con risultati meno robusti.
Nel caso della neuropatia autonomica, si ricorre soprattutto a terapie sintomatiche, a strategie per l’ipotensione ortostatica e i vari disturbi disfunzionali, come le calze elastiche per facilitare il ritorno venoso, la caffeina per l’ipotensione ortostatica, i farmaci per la disfunzione erettile, i procinetici per la gastroparesi.
Nel caso della neuropatia dolorosa si ricorre all’uso di farmaci per il dolore. “Per molti anni – ha spiegato la prof.ssa Frontoni – sono state utilizzate terapie del tutto aspecifiche (FANS, benzodiazepine, etc) con scarso beneficio. Oggi, disponiamo invece di un certo numero di classi terapeutiche per il dolore; ampiamente utilizzato è il gabapentin; una grande svolta nella terapia del dolore è stato l’utilizzo della duloxetina che nasceva come antidepressivo ma che ha poi dimostrato di avere un’efficacia importante nel dolore neuropatico. Nelle forme dolorose possono essere utilizzati infine altri farmaci considerati però di seconda linea, come il tramadolo e l’ossicodone e la più recente associazione ossicodone/naloxone. Le forme dolorose e gravi sono purtroppo molto frequenti. Per questo è così importante fare una diagnosi precoce e accurata; troppo spesso, i disturbi di questi pazienti vengono sottovalutati o considerati aspecifici”.
I nuovi farmaci sperimentali per trattare la causa (patogenetici)
Molti approcci sperimentali sono orientati ad una terapia patogenetica, che riesca a riparare il danno nervoso, a normalizzare il nervo, attraverso ad esempio una mielinizzazione (ripristino della guaina mielinica). Diversi studi sono in corso ma mancano ancora i dati sull’uomo. Il topiloxostat ad esempio, un nuovo trattamento testato per ora solo sui topi, sembra riuscire a sopprimere le alterazioni infiammatorie in fase precoce. Un’altra molecola, l’exendin-4 sembra favorire i processi di rimielinizzazione. Altre strategie, anch’esse in fase sperimentale, prevedono una crema con nanoparticelle alla resinferatoxina. Altri farmaci sembrano favorire (ma sempre su modelli animali, per il momento) una rigenerazione nervosa a livello del gangli nervosi della colonna vertebrale.
References
- NEURODIAB 2018, Roma, 4-7 settembre 2018 – Scientific Program and Abstract Books
- Comunicato Stampa SID, Società Italiana di Diabetologia. Roma, 3 settembre 2018
- Speciale antiossidanti liberi »
- Acido alfa-lipoico: la guardia del corpo dei nostri nervi e non solo »
- Neuropatia Diabetica: l’ultimo Position Statement dell’ADA »
- Dementia and Risk Reduction – An analysis of protective and modifiable factors. World Alzheimer Report 2014
- Improving healthcare for people living with dementia coverage, Quality and costs now and in the future. World Alzheimer Report 2016
- Alissa Sauer – How Alzheimer’s Could Be Type 2 Diabetes
- Kawser Akter, Emily A Lanza, et al – Diabetes mellitus and Alzheimer’s disease: shared pathology and treatment? Br J Clin Pharmacol 2011 Mar; 71(3): 365–376
- Central Nervous System Involvement in Diabetic Neuropathy. Current Diabetes Reports 11(4):310-22 · June 2011
- Dinesh Selvarajah, Solomon Tesfaye – Central nervous system involvement in diabetes mellitus. Current Diabetes Reports, Nov 2006, Volume 6, Issue 6, pp 431–438
- Ciudin A, Simó-Servat O – Retinal Microperimetry: A New Tool for Identifying Patients With Type 2 Diabetes at Risk for Developing Alzheimer Disease. Diabetes 2017 Dec;66(12):3098-3104
- Emilia Vaccaro – Neurostimolazione nel trattamento del dolore neuropatico e della fibromialgia, ecco cosa dicono le nuove linee guida europee. Pharmastar, febbraio 2017
- Cruccu G, Garcia-Larrea L, et al – EAN guidelines on central neurostimulation therapy in chronic pain conditions. Eur J Neurol 2016 Oct;23(10):1489-99





